Grundlagen der Metallkunde: Unterschied zwischen den Versionen
Horsch (Diskussion | Beiträge) (→Einfluss der Legierungselemente im Stahl) |
Horsch (Diskussion | Beiträge) (→Legierungselemente) |
||
| Zeile 163: | Zeile 163: | ||
{| class="wikitable" | {| class="wikitable" | ||
|-class="hintergrundfarbe9" | |-class="hintergrundfarbe9" | ||
| − | |||
|'''Einfluss der Legierungselemente auf die Aufhärtung und Einhärtung bei Stahl'''<ref>Siegener Werkzeug und Härtetechnik GmbH, Seminar "Was man in der Stahlindustrie über Wärmebehandlung wissen sollte "</ref> | |'''Einfluss der Legierungselemente auf die Aufhärtung und Einhärtung bei Stahl'''<ref>Siegener Werkzeug und Härtetechnik GmbH, Seminar "Was man in der Stahlindustrie über Wärmebehandlung wissen sollte "</ref> | ||
|- | |- | ||
| − | |||
|[[File:Aufhärtbarkeit-2.jpg|800px]] | |[[File:Aufhärtbarkeit-2.jpg|800px]] | ||
|} | |} | ||
Version vom 14. Juli 2019, 13:55 Uhr
Verlinkte Seiten
Inhaltsverzeichnis
Grundlagen der Metallkunde
Schon seit vielen Jahrtausenden gibt es praktische Erfahrungen mit Metallen. Ein wichtiger Motor der Entwicklung neuer Werkstoffe und Legierungen war die Herstellung von Waffen. In der Frühzeit der Metallurgie konnte es von großem Vorteil sein, wenn man die besseren Werkstoffe einsetzen konnte. So war die Entwicklung und der Einsatz von Stahl entscheidend für den Ausgang einer Schlacht wenn der Gegner noch Bronzeklingen einsetzte[1].
Einfache schmiedbare Eisenwerkstoffe wurden bereits bei den Hethitern vor ca. 3500 Jahren hergestellt, z. B. für Waffen. Die frühe Verhüttung von Eisenerz ist bereits für das 2. Jahrtausend v. Chr. im damaligen Hethiter-Reich belegt, wo auch um die Mitte des 1. Jahrtausends v. Chr. wohl erstmals ein einfacher härtbarer Stahl hergestellt wurde.[2] Eisen verdrängte allmählich die zuvor genutzten Kupferwerkstoffe (Bronze), da es härter und fester ist. Genutzt wurde Eisen vor allem für Waffen und Rüstungen, sowie Werkzeuge, weniger in der Landwirtschaft. Eisenerze waren nahezu überall zu finden, während die zur Bronze-Herstellung benötigten Metalle Kupfer und Zinn selten waren und nicht an denselben Orten vorkamen. Zur Eisengewinnung wurde Holzkohle benötigt, die aus Holz gewonnen werden konnte[3][4].
Die dabei gewonnenen Erkenntnisse über die MetalIgewinnung, -bearbeitung und -verarbeitung entstanden zunächst durch zufällige Beobachtungen und erst später durch planmäßige Untersuchungen. Es gab bereits eine hochentwickelte Metalltechnik, bevor die chemischen und physikalischen Zusammenhänge verstanden wurden. Die eigentliche wissenschaftliche Erforschung der Metalle begann erst vor etwa 120 Jahren, wobei die Wissenschaft zunächst hinter der Praxis zurückblieb. Erst im 20. Jahrhundert hat die wissenschaftliche Metalltechnik die praktische überholt, sodass Werkstoffe gezielt verbessert oder neue Werkstoffe entwickelt werden konnten.
Die Metalltechnik wird unterteilt in Metallurgie und Metallkunde. In der Metallurgie sind die Gewinnungsverfahren zusammengefasst, in der Metallkunde werden die Eigenschaften der Metalle beschrieben. In der allgemeinen Metallkunde werden die in verschiedenen Metallen gemeinsamen Zustände und Vorgänge beschrieben und in der speziellen Metallkunde werden die Besonderheiten von bestimmten Metallen und Legierungen verdeutlicht. Die theoretische Metallkunde wird auch als Metallphysik (Teilgebiet der Festkörperphysik) bezeichnet, da diese eine enge Verflechtung mit der Physik aufweist.[1]
Aufbau der Metalle
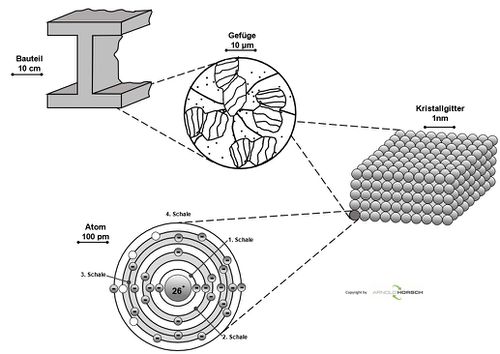
Um die Besonderheiten eines Werkstoffes und dessen Eigenschaften zu verstehen, ist es notwendig, den inneren Aufbau zu kennen. Bereits bei makroskopischer Betrachtung werden wesentliche Unterschiede zwischen Metallen und anderen Stoffen deutlich, Metalle weisen einen für sie typischen Glanz auf, haben eine gute elektrische Leitfähigkeit und sind plastisch verformbar. Aber allein aus der Betrachtung eines Bauteils (Bild oben) können keine Rückschlüsse über seinen inneren Aufbau erfolgen. Mikroskopische Aufnahmen (Bild mitte) zeigen das so genannte Gefüge eines Metalls, das aus vielen kleinen Bereichen, den Körnern (Kristalliten) besteht. Das Gefüge eines metallischen Werkstücks, die Gesamtheit der im Lichtmikroskop sichtbaren Körner, beeinflusst dessen Eigenschaften, so dass Gefügeuntersuchungen von großer Bedeutung für die Metalltechnik sind. Die Körner wiederum sind aus Atomen aufgebaut, die in Form eines Kristallgitters regelmäßig angeordnet sind (Bild unten). Der kristalline Aufbau eines metallischen Werkstoffs kann mithilfe von Röntgenfeinstrukturuntersuchungen betrachtet werden.
Zwischen den einzelnen Körnern befinden sich die Korngrenzen, die in der Gefügeaufnahme als dunkle unregelmäßige Linien erscheinen. Die Korngrenzen erscheinen aufgrund der Größenverhältnisse als unregelmäßige Linien, da die Korndurchmesser etwa 10000 Atomdurchmessern entsprechen und daher die atomaren Begrenzungen der Körner nicht zu sehen sind.
Metalle sind polykristallin, sie bestehen aus vielen Körnern. Nur unter bestimmten Erstarrungsbedingungen können Einkristalle, also Werkstücke ohne Korngrenzen, hergestellt werden, wie z. B. Silicium-Einkristalle für die Halbleitertechnik[1].
Zustandsdiagramme
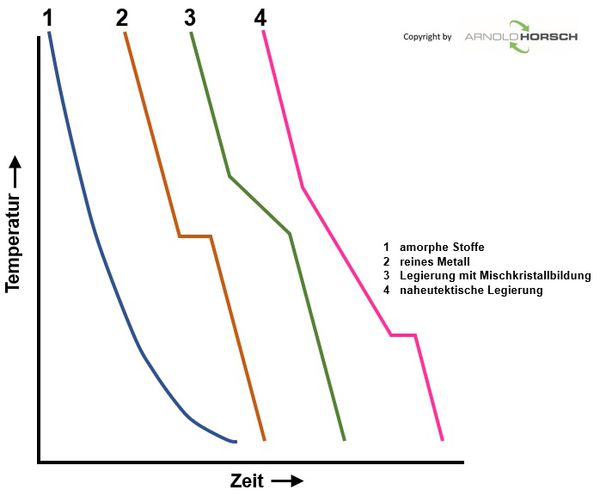
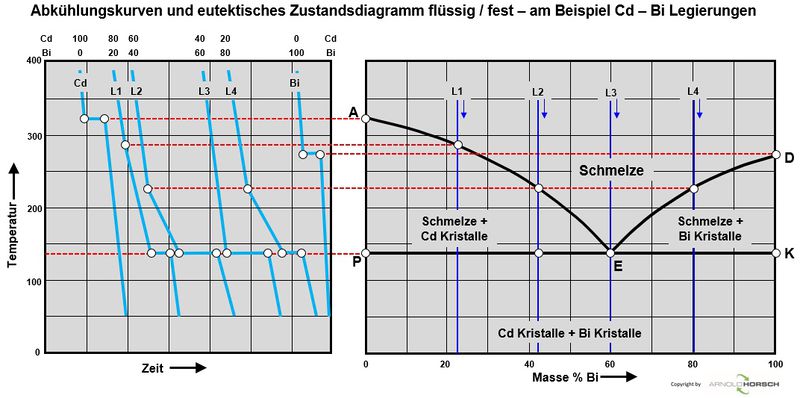
Von besonderem Interesse sind bei Metallen und deren Legierungen die Übergänge von fest nach flüssig sowie eventuelle Änderungen bei verschiedenen Temperaturen im festen Zustand, Umwandlungen des Kristallsystems machen sich auch durch durch Haltepunkte im festen Zustand bemerkbar. Die Messergebnisse werden in Temperatur-Zeit-Diagramme eingetragen. Die miteinander verbundenen Punkte ergeben die Aufheiz- und Abkühlkurven. Aus diesen Abkühlkurven können die Zustandsdiagramme der Metalle erstellt werden, das verstehen von Zustandsdiagrammen ist wichtig um die Vorgänge in den Metallen zu verstehen, die Basis zur Erstellung von Zustandsdiagrammen sind also Abkühlkurven von reinem Metallen und deren Legierungen. Zur Erstellung von Zustandsdiagrammen wird die Thermoanalyse eingesetzt.
Die nachfolgenden Abkühlkurven sind beispielsweise charakteristisch für amorphe Stoffe (1), ein reines Element bzw. ein Eutektikum (2), eine Legierung mit Mischkristallbildung (3) und eine naheutektische Legierung (4).
Die Basiszustandsdiagramme von Legierungen aus 2 Elementen sind binäre Zustandsdiagramme hier unterscheiden wir-
- Binäres Zustandsdiagramm für vollständige Löslichkeit im flüssigem und festen und Zustand
- Binäres Zustandsdiagramm eutektisch für völlige Unlöslichkeit im flüssigem und festen und Zustand
Abkühl- und Aufheizkurven
In Abkühl- und Aufheizkurven werden Kurzzeichen verwendet die unabhängig vom jeweiligen jeweiligen Metall verwendet werden.
| Kurzzeichen | Bezeichnung | Bezeichnung D | Bedeutung |
|---|---|---|---|
|
A |
arrēt | Haltepunkt | Punkt an dem die Abkühl- und Aufheizkurven einen Haltepunkt oder einen Veränderung der Abkühl- und Aufheizgeschwindigkeit aufweisen. |
|
r |
refroidissement | Abkühlung | Zusätzliche Kennzeichnung zu A, bedeutet das dieser Punkt auf einer Abkühlkurve ist. |
|
c |
chauffage | Erwärmung | Zusätzliche Kennzeichnung zu A, bedeutet das dieser Punkt auf einer Aufheizkurve ist. |
|
1 |
Zahl (tiefgestellt) | Zusätzliche Kennzeichnung zu A, bezeichnet die Reihenfolge der Abkühl- und Aufheizpunkte. | |
|
Ar |
arrēt refroidissement | Abkühlung Haltepunkt | Haltepunkt auf der Abkühlkurve, wird immer dann ohne Angabe einer Zahl verwendet wenn Start und Ende des Haltepunktes die gleiche Temperatur aufweisen. |
|
Ac |
arrēt chauffage | Erwärmung Haltepunkt | Haltepunkt auf einer Aufheizkurve, wird immer dann ohne Angabe einer Zahl verwendet wenn Start und Ende des Haltepunktes die gleiche Temperatur aufweisen. |
|
Ar1 |
arrēt refroidissement 1 | Abkühlung Haltepunkt 1 | erster Haltepunkt auf einer Abkühlkurve |
|
Ar2 |
arrēt refroidissement 2 | Abkühlung Haltepunkt 2 | zweiter Haltepunkt auf einer Abkühlkurve |
|
Ac1 |
arrēt chauffage 1 | Erwärmung Haltepunkt 1 | erster Haltepunkt auf einer Aufheizkurve |
|
Ac2 |
arrēt chauffage 2 | Erwärmung Haltepunkt 2 | zweiter Haltepunkt auf einer Aufheizkurve |
Abkühlungskurven von reinen Metallen
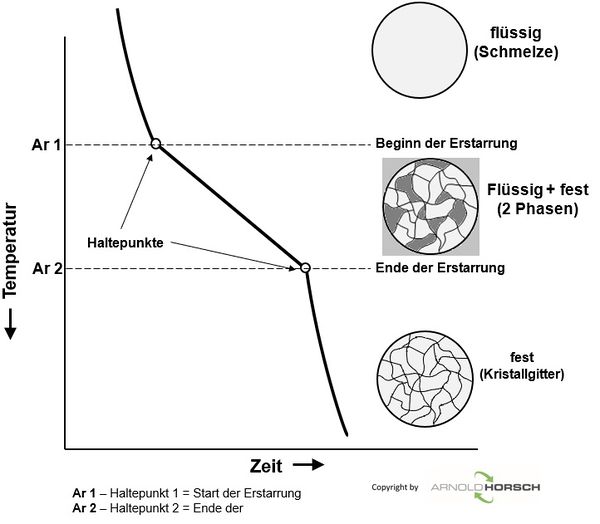
Aufheiz- und Abkühlkurven von reinen Metallen haben ein grundsätzliches Verhalten, beim Schmelzpunkt der Metalle gibt es ein Halten der Temperatur während der Erstarrung.
Beim Erstarren eines flüssigen Metalls bilden sich zunächst Kristallisationskeime, die allmählich wachsen, bis die so entstandenen Kristallite zusammenstoßen.
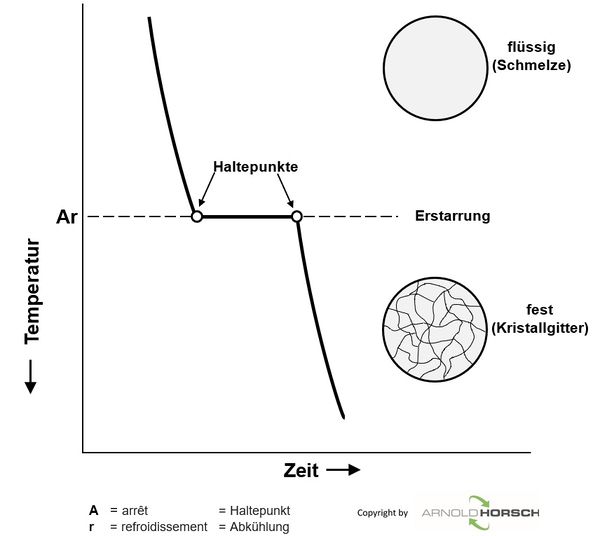
Abkühlungskurven einer Legierungen
Abkühlkurven von Legierungen haben ein grundsätzliches Verhalten, beim Schmelzpunkt der Legierung gibt es keinen Haltepunkt der Temperatur, sondern einen Temperaturübergang, während der Erstarrung. Auch beim Erstarren einer flüssigen Legierung bilden sich zunächst Kristallisationskeime, die allmählich wachsen, bis die so entstandenen Kristallite zusammenstoßen. Ausnahme sind hier eutektische Legierungen, diese haben das Erstarrungsverhalten einer reinen Legierung, nur nicht bei der Erstarrungstemperatur eines reinen Metalls.
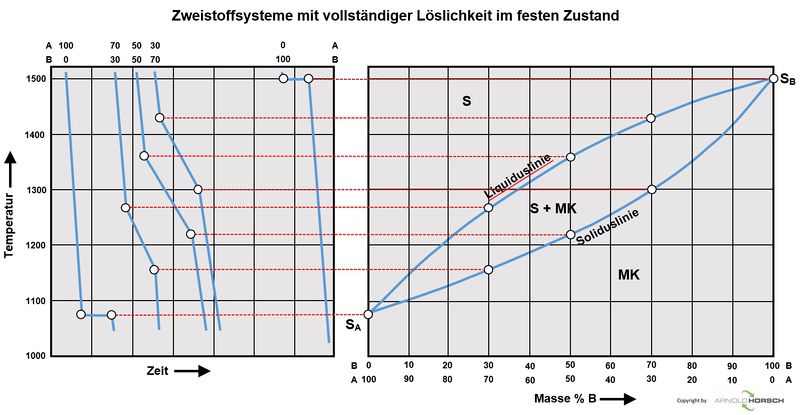
Binäre Zustandsdiagramme
Binäres Zustandsdiagramm für vollständige Löslichkeit im flüssigem und festen und Zustand
Binäres Zustandsdiagramm eutektisch für völlige Unlöslichkeit im flüssigem und festen und Zustand
Seiten befindet sich im Aufbau.
Die Legierungselemente im Stahl
Was ist der Unterschied zwischen Stahl und Eisen?
Stahl ist ein Material, in dem das Gewichtsverhältnis von Eisen grösser ist als jedes andere Element (Legierungselement) und kann bis zu 2,06 % Kohlenstoff enthalten. Die Grenze von 2,06% Kohlenstoff wurde vereinbart als Grenze welche den Stahl vom Gusseisen unterscheidet. Einfach gesagt
- Stahl ist eine Legierung, Verbindung mit Eisen, Kohlenstoff und anderen Legierungselementen mit weniger als 2,06% C
- Eisen (Gusseisen) ist eine Legierung, Verbindung mit Eisen, Kohlenstoff und anderen Legierungselementen mit mehr als 2,06% C
Einfluss der Legierungselemente im Stahl
An keinem anderen Werkstoff lassen sich die Eigenschaften durch Legieren in einem so großen Umfang ändern wie bei Stahl. Der legierte Stahl enthält außer Eisen und Kohlenstoff im allgemeinen mehrere Legierungselemente. Wegen der komplexen Wechselwirkungen zwischen den Legierungselementen und ihrer nicht additiven Wirkung lassen sich die eingetretenen Eigenschaftsänderungen daher nur in sehr allgemeiner Form angeben.
Legierungselemente werden dem Stahl in genauen Mengen zugesetzt, um bestimmte Eigenschaften zu erzeugen bzw. zu verbessern oder unerwünschte zu beseitigen oder zu mildern. Als legiert gelten Stahlsorten, wenn der Legierungsgehalt für wenigstens ein Element die Grenzwerte der nachfolgenden Tabelle erreicht oder überschreitet. Die unerwünschten Beimengungen (Verunreinigungen) wie z. B. Kohlenstoff, Phosphor, Schwefel, Stickstoff und die für das Desoxidieren erforderlichen Elemente gelten danach nicht als Legierungselemente.
Die Abgrenzung der unlegierten von den legierten Stählen, ergolgt mit den maßgebenden Gehalten der Legierungselemente nach DIN EN 10020.
Nach DIN EN 10027-1 werden lediglich unlegierte und legierte Stähle unterschieden. Die legierten Stähle teilt man in der Praxis zzt. noch häufig in die niedriglegierten und hochlegierten ein. Diese Festlegung dient aber lediglich dem Zweck einer einfacheren Namengebung und verfolgt nicht die Absicht, den Begriff legierter Stahl festzulegen.
- Unlegierte Stähle
- Stähle, denen außer zum metallurgischen Prozess erforderlich, keine weiteren Legierungselemente zugefügt wurden
- Niedriglegierte Stähle:
- Der Gehalt keines Legierungselementes überschreitet 5 %.
- Hochlegierte Stähle:
- Der Gehalt eines Elementes beträgt mindestens 5 %.[5]
Die nachfolgende Tabelle gibt den max. % Anteil der zulässigen Element im unlegierten Stahl wieder.
| Unlegierter Stahl, nach DIN EN 10020 |
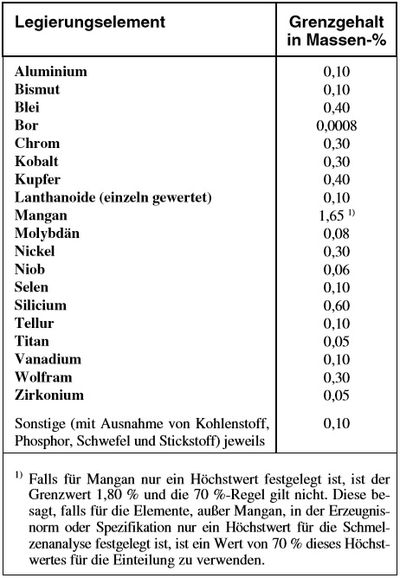
|
Legierungselemente
Die nachfolgende Graphik gibt den Grundsätzlichen Einfluss des Kohlenstoffs und der Legierungselemente wieder.
| Einfluss der Legierungselemente auf die Aufhärtung und Einhärtung bei Stahl[6] |
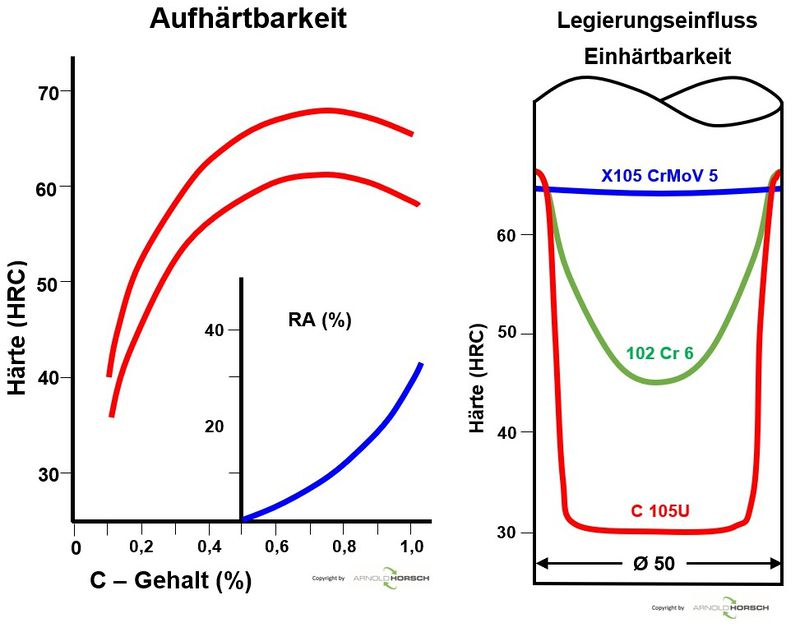
|
Legierungselement Aluminium
Aluminium wirkt in Eisen als starkes Desoxidationsmittel zur Stahlberuhigung (beim Gießprozess). Aluminium bildet außerdem mit Stickstoff Nitride (=> Nitrierstahl), es erhöht die Zunderbeständigkeit und erhöht die Koerzitivkraft. Außerdem wirkt Aluminium in hoch legierten Stählen ferritstabilisierend.
Legierungselement Beryllium
Durch die Wirkung von Beryllium als Legierungselement in Eisen wird das γ-Gebiet (Austenit) abgeschnürt. Beryllium wirkt als starkes Desoxidationsmittel bei der Stahlherstellung und es erhöht die Ausscheidungshärtung.
Als negative Wirkung senkt Beryllium als Legierungselement in Eisen die Zähigkeit.
Legierungselement Bor
Bor verzögert die Austenitumwandlung in der Ferritstufe bereits in sehr geringen Massenanteilen sehr wirkungsvoll. Im Bereich erhöhter Temperaturen verbessern mit Bor gebildete Ausscheidungen die Festigkeit austenitischer CrNi-Stähle.
Bor wirkt als Legierungselement in Eisen als starker Neutronen-Absorber. Diese Arte der Legierung findet daher in Stählen für den Atomkraftwerksbau Verwendung. Ferner erhöht Bor die Streckgrenze und Festigkeit des Stahls. Ein negativer Effekt von Bor als Legierungspartner ist, dass es die Korrosionsbeständigkeit verringert und bei Gusseisen mit Kugelgraphit zur Versprödung führt.
Legierungselement Cerium
Cerium wirkt in Eisen als Desoxidationsmittel und es erhöht die Zunderbeständigkeit. Es fördert bei Gusseisen mit Kugelgraphit (GGG) die Bildung von Kugelgraphit. Außerdem sind Eisen-Legierungen mit bis zu 30% Eisen pyrophor (wird in Feuerzeugen als Feuerstein verwendet).
Legierungselement Chrom
Chrom gehört zu den wichtigsten Legierungselementen der Stähle. Chrom senkt als Legierungselement in Eisen die kritische Abkühlgeschwindigkeit, steigert Verschleißfestigkeit, Warmfestigkeit Zunderbeständigkeit. Es erhöht die Zugfestigkeit, da es als Carbidbilder wirkt. Da es ab einem Massegehalt von 12,2% die Korrosionsbeständigkeit steigert, wird es zu Herstellung von Edelstahl verwendet (V2A, V4A). Außerdem wirkt es ferritstabilisierend und schnürt das γ-Gebiet ein.
Chrom hat eine nachteilige Wirkung, indem es die Kerbschlagarbeit und Schweißeignung verringert. Es senkt die Wärmeleitfähigkeit und die elektrische Leitfähigkeit.
Durch Herabsetzen der kritischen Abkühlgeschwindigkeit wird die Einhärtbarkeit wesentlich gesteigert. Eine Erhöhung der Härte wird weiterhin durch die karbidbildende Wirkung des Chroms hervorgerufen. Höhere Chromgehalte verbessern die Warmfestigkeit und Anlaßbetändigkeit. Die Zunderbeständigkeit wird insbesondere in Kombination mit Silizium oder Aluminium erhöht. Chromstähle sind gut härt- und vergütbar, sie neigen allerdings zur Anlaßsprödigkeit und in Gegenwart von Wasserstoff zur Flockenbildung, die jedoch bei Cr-Ni-Stählen durch die übliche Vakuumbehandlung kein Problem mehr darstellt. Da Stähle mit mehr als 12,2% Cr eine Passivschicht (O-adsorbierende Grenzschicht) bilden und damit gegen Korrosionsangriff medienunempfindlich werden, ist Chrom das wichtigste Legierungselement der hochlegierten rost- und säurebeständigen Stähle.
Chrom verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts.
Legierungselement Kohlenstoff
Die Wirkung von Kohlenstoff ist für die Werkstofftechnik von sehr hoher Bedeutung. Zum einen senkt Kohlenstoff als Legierungselement in Eisen den Schmelzpunkt, während er durch Fe3C-Bildung die Härte und Zugfestigkeit erhöht. Eine Eisenlegierung wird außerdem als Stahl bezeichnet, wenn der Kohlenstoffgehalt zwischen 0,002 % und 2,06 % liegt. Stahl lässt sich jedoch erst ab einem Kohlenstoffgehalt von 0,3% härten.
Wenn Kohlenstoff in der Legierung in größeren Mengen vorhanden ist, erhöht es die Sprödigkeit und senkt damit Schmiedbarkeit, Schweißeignung, Bruchdehnung und Kerbschlagarbeit. Die Erhöhung der Festigkeit und die Möglichkeit, Eisen durch Abschrecken zu härten, stellen die wichtigste Eigenschaft von Kohlenstoff als Legierungselement dar. Die kritische Abkühlgeschwindigkeit wird durch niedrige und mittlere Kohlenstoffgehalte stark abgesenkt (was gleichbedeutend ist mit einer Erhöhung der Härtbarkeit) und bleibt im Bereich von 0,6 bis 1,4% Kohlenstoff etwa gleich.
Legierungselement Kupfer
Kupfer erhöht als Legierungselement in Eisen die Witterungsbeständigkeit und Festigkeit, während es die Bruchdehnung deutlich verringert.
Legierungselement Mangan
Wird Mangan in Stahl zulegiert verbessert es die Schmiedbarkeit, die Schweißbarkeit, die Festigkeit und den Verschleißwiderstand. Außerdem hat Mangan in Eisen die positive Wirkung die Rotbruch-Neigung zu mindern.
Mangan verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts. Außerdem wirkt Mangan in hoch legierten Stählen ferritstabilisierend.
Legierungselement Molybdän
Molybdän erhöht die Härtbarkeit, Zugfestigkeit, Schweißbarkeit und Warmfestigkeit und verringert die Anlaßversprödung der chrom- und manganhaltigen Vergütungsstähle. Die dafür notwendigen Molybdängehalte liegen zwischen 0,2 und 0,4%. Negativ ist, dass der Haltepunkt A1 leicht nach oben verschoben wird. Außerdem senkt Molybdän die Schmiedbarkeit und Dehnbarkeit. Eine Zugabe von 1% Molybdän hat auf die Durchhärtung etwa den gleichen Einfluß wie eine Zulegierung von 2% Chrom. Aus seiner Eigenschaft Karbide zu bilden ergibt sich eine Erhöhung der Verschleißfestigkeit und Anlaßbeständigkeit, daher wird Molybdän in niedriglegierten Warmarbeitsstählen verwendet. In höher legierten Warmarbeitsstählen und in den Schnellarbeitsstählen kann Molybdän weitgehend Wolfram ersetzen. In Einsatzsstählen bewirkt Molybdän eine geringe Erhöhung der Eindringtiefe des Kohlenstoffs und führt zu einer Steigerung des Randkohlenstoffgehaltes. Austenitischen Stählen wird Molybdän zur Verbesserung der Korrosions- und Warmfestigkeit zulegiert. Ähnlich wie Chrom und Nickel neigt auch Molybdän zur Passivierung. Ein Zusatz von 2 bis 5% Molybdän verbessert die Lochfraßkorrosionsbeständigkeit hochlegierter Stähle. Bei hohen Temperaturen verbessert Molybdän die Zunderbeständigkeit des Stahls.
Molybdän verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts.
Legierungselement Nickel
Nickel erhöht in Stahl die die Zugfestigkeit und die Streckgrenze.
Ein nachteiliger Einfluss von Nickel auf Stahl ist, dass es den Haltepunkt A1 um 10 K je 1% Ni nach unten verschiebt. Außerdem wirkt Nickel in hoch legierten Stählen ferritstabilisierend.
Nickel gehört zu den Legierungselementen, die eine Erstarrung nach dem stabilen Eisen-Kohlenstoffsystem begünstigen. Durch die Verringerung der kritischen Abkühlgeschwindigkeit erhöht Nickel die Durchhärtung und Durchvergütung. Weiter erhöht Nickel vor allem die Zähigkeit, besonders im Tieftemperaturgebiet, wirkt kornfeinend und senkt die Überhitzungsempflndlichkeit. Ab einem Anteil von 8% macht Nickel einen Stahl korrosionsbeständig, der 18/10 Chrom-Nickel-Stahl zählt zu den Hauptvertretern der korrosionsbeständigen austenitischen Stähle. Der Wärmeausdehnungskoeffizient von Stählen erreicht bei 36% Nickel ein Minimum (Invarstahl). Der elektrische Widerstand wird durch Nickel erhöht (Heizleiterdrähte, Konstantan).
Legierungselement Phosphor
Phosphor erhöht in Eisen-Legierungen die Zugfestigkeit, Härte und Korrosionsbeständigkeit.
Es hebt jedoch den Haltepunkt A1 leicht an und führt zu Versprödung.
Legierungselement Schwefel Schwefel als Legierungselement von Eisen erhöht die Zerspanbarkeit, mindert jedoch die Duktilität.
Legierungselement Silizium
Silizium erhöht in Eisen-Legierungen die Zunderbeständigkeit, es ist ein Mischkristallhärter und behindert die Bildung von Carbiden. Bei der Stahlherstellung hat es die positive Wirkung die Schmelze dünnflüssiger zu machen und dient als Desoxidationsmittel. Ein weiterer positiver Einfluss von Silizium auf Stahl ist, dass es die Zugfestigkeit, Streckgrenze und Zunderbeständigkeit erhöht.
Darüber hinaus verschiebt Silizium den Haltepunkt A1 nach oben (um 20 - 30 K je 1% Si, jedoch nur bis 3%). Es verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts. Außerdem wirkt Silizium in hoch legierten Stählen ferritstabilisierend.
Legierungselement Titan
Titan verhindert als Legierungselement in Eisen-Legierungen die interkristalline Korrosion durch Bildung von TiC.
Legierungselement Vanadium
Vanadium erhöht in Eisen-Legierungen die Zugfestigkeit.
Es verschiebt jedoch den Haltepunkt A1 leicht nach oben
Legierungselement Wolfram
Wolfram wirkt als Carbidbildner und erhöht somit die Zugfestigkeit deutlich.
Es verschiebt jedoch den Haltepunkt A1 schwach nach oben.
Verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts.
Einzelnachweise
<references > [1]
<ref name="Die Werkstoffprüfverfahren ">Arnold Horsch, Vortrag, Die Werkstoffprüfverfahren, Seminar Härteprüfung in Theorie und Praxis, Arnold Horsch
- ↑ 1,0 1,1 1,2 1,3 1,4 Volker Läpple, Berthold Drube , Georg Wittke, Catrin Kammer ,Werkstofftechnik Maschinenbau – 5. Auflage, VERLAG EUROPA-LEHRMITTEL, Haan-Gruiten
- ↑ Friedrich Cornelius: Geistesgeschichte der Frühzeit. Band 1, Verlag Brill Archive, 1960, S. 132.
- ↑ https://www.wikiwand.com/de/Stahl
- ↑ Referenzfehler: Es ist ein ungültiger
<ref>-Tag vorhanden: Für die Referenz namensDie Werkstoffprüfverfahrenwurde kein Text angegeben. - ↑ Referenzfehler: Es ist ein ungültiger
<ref>-Tag vorhanden: Für die Referenz namensWerkstoffkundewurde kein Text angegeben. - ↑ Siegener Werkzeug und Härtetechnik GmbH, Seminar "Was man in der Stahlindustrie über Wärmebehandlung wissen sollte "