Grundlagen der Metallkunde
Verlinkte Seiten
Diese Seiten befinden sich im Aufbau, sind noch nicht vollständig und teilweise mit Fehlern behaftet, da Sie noch nicht korrektur bearbeitet wurden.
Inhaltsverzeichnis
Grundlagen der Metallkunde
Schon seit vielen Jahrtausenden gibt es praktische Erfahrungen mit Metallen. Ein wichtiger Motor der Entwicklung neuer Werkstoffe und Legierungen war die Herstellung von Waffen. In der Frühzeit der Metallurgie konnte es von großem Vorteil sein, wenn man die besseren Werkstoffe einsetzen konnte. So war die Entwicklung und der Einsatz von Stahl entscheidend für den Ausgang einer Schlacht wenn der Gegner noch Bronzeklingen einsetzte[1].
Einfache schmiedbare Eisenwerkstoffe wurden bereits bei den Hethitern vor ca. 3500 Jahren hergestellt, z. B. für Waffen. Die frühe Verhüttung von Eisenerz ist bereits für das 2. Jahrtausend v. Chr. im damaligen Hethiter-Reich belegt, wo auch um die Mitte des 1. Jahrtausends v. Chr. wohl erstmals ein einfacher härtbarer Stahl hergestellt wurde.[2] Eisen verdrängte allmählich die zuvor genutzten Kupferwerkstoffe (Bronze), da es härter und fester ist. Genutzt wurde Eisen vor allem für Waffen und Rüstungen, sowie Werkzeuge, weniger in der Landwirtschaft. Eisenerze waren nahezu überall zu finden, während die zur Bronze-Herstellung benötigten Metalle Kupfer und Zinn selten waren und nicht an denselben Orten vorkamen. Zur Eisengewinnung wurde Holzkohle benötigt, die aus Holz gewonnen werden konnte[3][4].
Die dabei gewonnenen Erkenntnisse über die MetalIgewinnung, -bearbeitung und -verarbeitung entstanden zunächst durch zufällige Beobachtungen und erst später durch planmäßige Untersuchungen. Es gab bereits eine hochentwickelte Metalltechnik, bevor die chemischen und physikalischen Zusammenhänge verstanden wurden. Die eigentliche wissenschaftliche Erforschung der Metalle begann erst vor etwa 160 Jahren, wobei die Wissenschaft zunächst hinter der Praxis zurückblieb. Erst im 20. Jahrhundert hat die wissenschaftliche Metalltechnik die praktische überholt, sodass Werkstoffe gezielt verbessert oder neue Werkstoffe entwickelt werden konnten.
Die Metalltechnik wird unterteilt in Metallurgie und Metallkunde. In der Metallurgie sind die Gewinnungsverfahren zusammengefasst, in der Metallkunde werden die Eigenschaften der Metalle beschrieben. In der allgemeinen Metallkunde werden die in verschiedenen Metallen gemeinsamen Zustände und Vorgänge beschrieben und in der speziellen Metallkunde werden die Besonderheiten von bestimmten Metallen und Legierungen verdeutlicht. Die theoretische Metallkunde wird auch als Metallphysik (Teilgebiet der Festkörperphysik) bezeichnet, da diese eine enge Verflechtung mit der Physik aufweist.[1]
Aufbau der Metalle
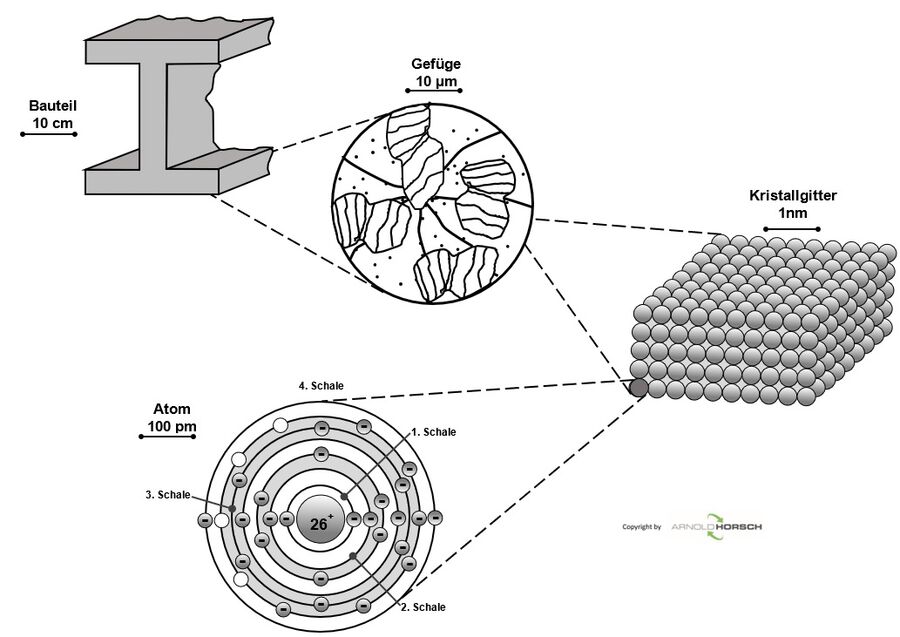
Um die Besonderheiten eines Werkstoffes und dessen Eigenschaften zu verstehen, ist es notwendig, den inneren Aufbau zu kennen. Bereits bei makroskopischer Betrachtung werden wesentliche Unterschiede zwischen Metallen und anderen Stoffen deutlich, Metalle weisen einen für sie typischen Glanz auf, haben eine gute elektrische Leitfähigkeit und sind plastisch verformbar. Aber allein aus der Betrachtung eines Bauteils (Bild oben) können keine Rückschlüsse über seinen inneren Aufbau erfolgen. Mikroskopische Aufnahmen (Bild mitte) zeigen das so genannte Gefüge eines Metalls, das aus vielen kleinen Bereichen, den Körnern (Kristalliten) besteht. Das Gefüge eines metallischen Werkstücks, die Gesamtheit der im Lichtmikroskop sichtbaren Körner, beeinflusst dessen Eigenschaften, so dass Gefügeuntersuchungen von großer Bedeutung für die Metalltechnik sind. Die Körner wiederum sind aus Atomen aufgebaut, die in Form eines Kristallgitters regelmäßig angeordnet sind (Bild unten). Der kristalline Aufbau eines metallischen Werkstoffs kann mithilfe von Röntgenfeinstrukturuntersuchungen betrachtet werden.
Zwischen den einzelnen Körnern befinden sich die Korngrenzen, die in der Gefügeaufnahme als dunkle unregelmäßige Linien erscheinen. Die Korngrenzen erscheinen aufgrund der Größenverhältnisse als unregelmäßige Linien, da die Korndurchmesser etwa 10000 Atomdurchmessern entsprechen und daher die atomaren Begrenzungen der Körner nicht zu sehen sind.
Metalle sind polykristallin, sie bestehen aus vielen Körnern. Nur unter bestimmten Erstarrungsbedingungen können Einkristalle, also Werkstücke ohne Korngrenzen, hergestellt werden, wie z. B. Silicium-Einkristalle für die Halbleitertechnik[1].
Zustandsdiagramme
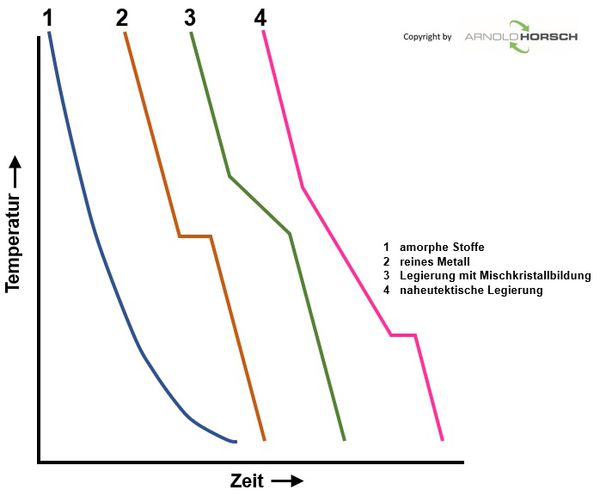
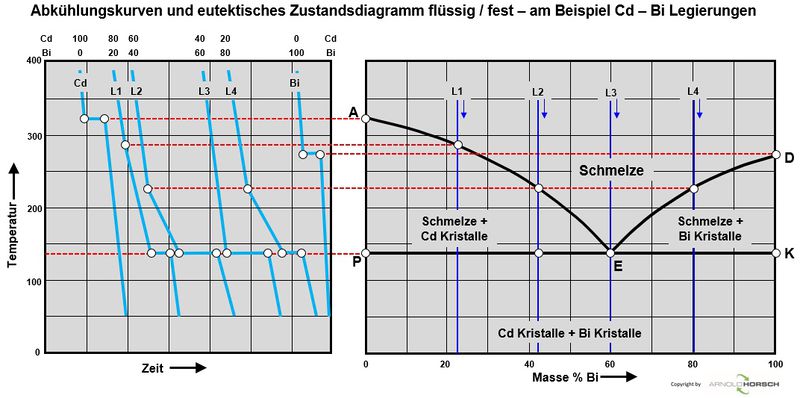
Von besonderem Interesse sind bei Metallen und deren Legierungen die Übergänge von fest nach flüssig sowie eventuelle Änderungen bei verschiedenen Temperaturen im festen Zustand, Umwandlungen des Kristallsystems machen sich auch durch durch Haltepunkte im festen Zustand bemerkbar. Die Messergebnisse werden in Temperatur-Zeit-Diagramme eingetragen. Die miteinander verbundenen Punkte ergeben die Aufheiz- und Abkühlkurven. Aus diesen Abkühlkurven können die Zustandsdiagramme der Metalle erstellt werden, das verstehen von Zustandsdiagrammen ist wichtig um die Vorgänge in den Metallen zu verstehen, die Basis zur Erstellung von Zustandsdiagrammen sind also Abkühlkurven von reinem Metallen und deren Legierungen. Zur Erstellung von Zustandsdiagrammen wird die Thermoanalyse eingesetzt.
Die nachfolgenden Abkühlkurven sind beispielsweise charakteristisch für amorphe Stoffe (1), ein reines Element bzw. ein Eutektikum (2), eine Legierung mit Mischkristallbildung (3) und eine naheutektische Legierung (4).
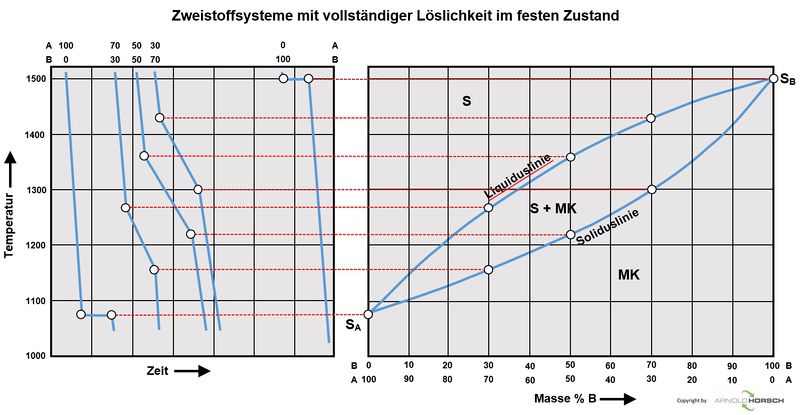
Die Basiszustandsdiagramme von Legierungen aus 2 Elementen sind binäre Zustandsdiagramme hier unterscheiden wir-
- Binäres Zustandsdiagramm für vollständige Löslichkeit im flüssigem und festen und Zustand
- Binäres Zustandsdiagramm eutektisch für völlige Unlöslichkeit im flüssigem und festen und Zustand
Abkühl- und Aufheizkurven
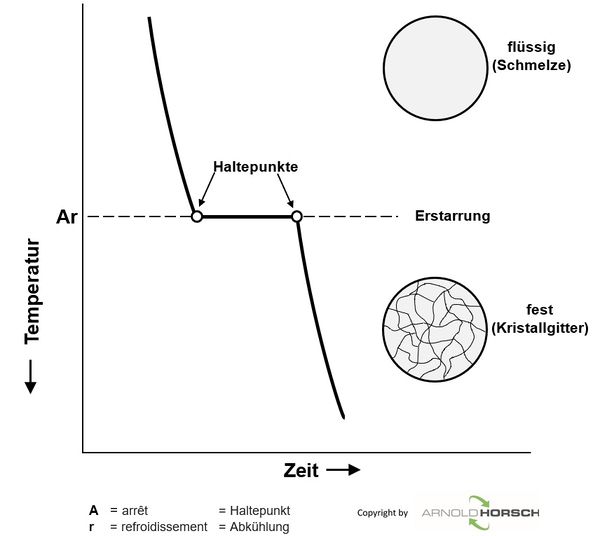
In Abkühl- und Aufheizkurven werden Kurzzeichen verwendet die unabhängig vom jeweiligen Metall verwendet werden.
| Kurzzeichen | Bezeichnung international | Bezeichnung Deutsch | Bedeutung |
|---|---|---|---|
| A | arrēt | Haltepunkt | Punkt an dem die Abkühl- und Aufheizkurven einen Haltepunkt oder einen Veränderung der Abkühl- und Aufheizgeschwindigkeit aufweisen. |
| c | chauffage (tiefgestellt) | Erwärmung | Zusätzliche Kennzeichnung zu A, bedeutet das dieser Punkt auf einer Aufheizkurve ist. |
| r | refroidissement (tiefgestellt) | Abkühlung | Zusätzliche Kennzeichnung zu A, bedeutet das dieser Punkt auf einer Abkühlkurve ist. |
| 1 | Zahl (tiefgestellt) | Zusätzliche Kennzeichnung zu c + r, bezeichnet die Reihenfolge der Abkühl- und Aufheizpunkte. | |
| Ac | arrēt chauffage | Erwärmung Haltepunkt | Haltepunkt auf einer Aufheizkurve, wird immer dann ohne Angabe einer Zahl verwendet wenn Start und Ende des Haltepunktes die gleiche Temperatur aufweisen. |
| Ac1 | arrēt chauffage 1 | Erwärmung Haltepunkt 1 | erster Haltepunkt auf einer Aufheizkurve |
| Ac2 | arrēt chauffage 2 | Erwärmung Haltepunkt 2 | zweiter Haltepunkt auf einer Aufheizkurve |
| Ar | arrēt refroidissement | Abkühlung Haltepunkt | Haltepunkt auf einer Abkühlkurve, wird immer dann ohne Angabe einer Zahl verwendet wenn Start und Ende des Haltepunktes die gleiche Temperatur aufweisen. |
| Ar1 | arrēt refroidissement 1 | Abkühlung Haltepunkt 1 | erster Haltepunkt auf einer Abkühlkurve |
| Ar2 | arrēt refroidissement 2 | Abkühlung Haltepunkt 2 | zweiter Haltepunkt auf einer Abkühlkurve |
Abkühlungskurven von reinen Metallen
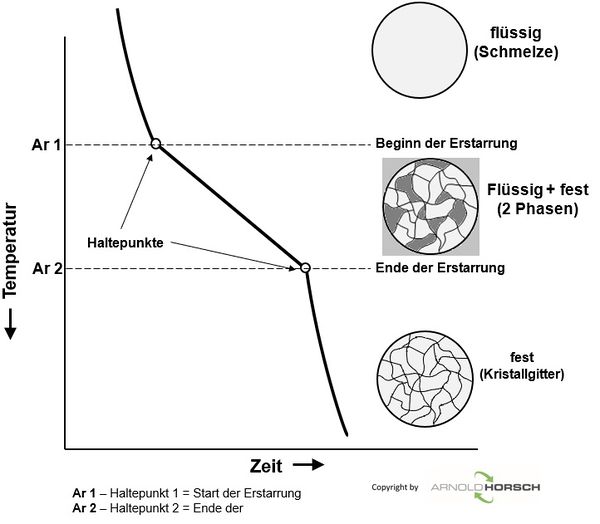
Aufheiz- und Abkühlkurven von reinen Metallen haben ein grundsätzliches Verhalten, beim Schmelzpunkt der Metalle gibt es ein Halten der Temperatur während der Erstarrung.
Beim Erstarren eines flüssigen Metalls bilden sich zunächst Kristallisationskeime, die allmählich wachsen, bis die so entstandenen Kristallite zusammenstoßen.
Abkühlungskurven einer Legierungen
Abkühlkurven von Legierungen haben ein grundsätzlich anderes Verhalten, beim Schmelzpunkt der Legierung gibt es keinen Haltepunkt der Temperatur, sondern einen Temperaturübergang, während der Erstarrung. Auch beim Erstarren einer flüssigen Legierung bilden sich zunächst Kristallisationskeime, die allmählich wachsen, bis die so entstandenen Kristallite zusammenstoßen. Ausnahme sind hier eutektische Legierungen, diese haben das Erstarrungsverhalten einer reinen Legierung, nur nicht bei der Erstarrungstemperatur eines reinen Metalls.
Binäre Zustandsdiagramme
Binäres Zustandsdiagramm für vollständige Löslichkeit im flüssigem und festen und Zustand
Binäres Zustandsdiagramm eutektisch für völlige Unlöslichkeit im flüssigem und festen und Zustand
Der Werkstoff Eisen
Eisen ist ein chemisches Element mit dem Symbol Fe (lateinisch ferrum, ‚Eisen‘) und der Ordnungszahl 26. Es gehört zu den Übergangsmetallen, die im Periodensystem die 8. Nebengruppe (Eisen-Platin-Gruppe), nach der neuen Zählung die Gruppe 8 (Eisengruppe) bilden. Eisen ist, auf den Massenanteil (ppmw) bezogen, nach Sauerstoff, Silicium und Aluminium das vierthäufigste Element in der Erdkruste und nach Aluminium das häufigste Metall.
Moderne Eisenwerkstoffe mit einem Massenanteil des Kohlenstoffs von bis zu 2 % werden als Stahl bezeichnet, bei größerem Gehalt als Gusseisen. Die Unterscheidung beruht darauf, dass Gusseisen nicht plastisch verformbar, insbesondere nicht schmiedbar ist, während Stahl verformbar, also schmiedbar ist. Ältere Werkstoffe (vor etwa 1870) mit geringen Kohlenstoffgehalten werden als Schmiedeeisen (Wrought iron [5]) bezeichnet und weisen größere Verunreinigungen auf, da sie anders hergestellt wurden als moderner Stahl.[4]
Eisen-Kohlenstoff-Legierungen (Stahl) sind Härtebar, hierzu ist anzumerken das nur Stahl gehärtet werden kann. Der Begriff Härten wird auch fälschlicherweise bei einigen anderen Werkstoffen benutzt, beschreibt hier aber nicht den klassischen Vorgang des Härtens (modifikation) sondern andere Vorgänge wie Auslagern (Aluminium), daher sollte der Begriff Härten nur für Stahl genutzt werden.
Historisches
Belege für die Nutzung von Eisen in den verschiedenen Kulturen durch archäologische Funde sind gegenüber den Funden von Bronze relativ selten. Einerseits wurde Eisen in den ältesten Perioden der Geschichte nur in geringem Umfang genutzt, andererseits neigt Eisen an feuchter Luft, im Wasser und in der nassen Erde zur Korrosion, wodurch viele Gegenstände nicht erhalten blieben. Nur besondere Umstände oder große Ausmaße des Gegenstandes verhinderten den Verlust solcher Stücke.[6]
Etymologie[7]
In der Vergangenheit wurde angenommen, das keltische und germanische Wort für Eisen (kelt. *isarnon germ.(*isarna)) sei vom Illyrischen entlehnt worden. Auch wurde wegen des Gegensatzes zur weicheren Bronze eine Verwandtschaft von *isarnon zu lat. ira, ‚Zorn, Heftigkeit‘ vertreten. Das neuhochdeutsche Wort Eisen wird über ahd. īsa(r)n; aus urgerm. *īsarnan, und dieses aus gall. *īsarnon hergeleitet, eine illyrische Herkunft gilt dagegen heute als unwahrscheinlich. *isarnan und isarnon setzen sich außer im deutschen Eisen auch in den übrigen germanischen (eng. iron, nordfries. joorn, westfries. izer, ndl. IJzer, ) und keltischen (bret. houarn, kymr. haearn, irisches und schottisches Gälisch iarann, Manx yiarn) Sprachen fort.[4] [8] [9] [10]
Früheste Nutzung von Meteoriteneisen
Bevor die Menschen in den verschiedenen Kulturkreisen lernten, Eisen aus Erz zu gewinnen, nutzten sie das bereits vor der eigentlichen „Eisenzeit“ bekannte und an seinem spezifischen Nickelgehalt von etwa 5 bis 18 % erkennbare Meteoreisen oder auch Meteoriteneisen. Aufgrund seiner Seltenheit war dieses „Himmelseisen“ (altägyptisch: bj-n-pt = „Eisen des Himmels“) entsprechend wertvoll und wurde vorwiegend zu Kultgegenständen und Schmuck verarbeitet. So fand man im Alten Ägypten in zwei Gräbern aus vordynastischer Zeit Schmuckperlen aus Meteoreisen mit einem Nickelgehalt von ca. 7,5 %. Ebenso konnte die schon früh geäußerte Vermutung bestätigt werden, dass ein bei der Mumie des Pharao Tutanchamun gefundener Dolch aus Meteoreisen gefertigt worden war. Die ältesten bekannten Funde aus Meteoreisen stammen allerdings aus Mesopotamien, das von den dort lebenden Sumerern als „urudu-an-bar“ (= Kupfer des Himmels) bezeichnet wurde. Unter anderem wurde in der Stadt Ur ein Dolch mit einer Klinge aus Meteoreisen (10,8 % Ni) und goldbelegtem Griff entdeckt, dessen Herstellung auf eine Zeit um 3100 v. Chr. datiert ist.[4] [11]
Mittelmeerraum und Kleinasien
Die Nutzung von nickelfreiem, also terrestrischem Eisen muss in Mesopotamien ebenfalls schon früh erfolgt sein, belegt durch einen nickelfreien Eisendolch mit Bronzegriff aus der Zeit zwischen 3000 und 2700 v. Chr., der in den Ruinen von Ešnunna bei Tell Asmar im heutigen Irak gefunden wurde. Aus den Aufzeichnungen der Hethiter im Archiv von Boğazkale (ehemals Boğazköy) in Zentralanatolien geht hervor, dass Eisen bereits zur Zeit von König Anitta (ca. 1800 v. Chr.) bekannt war und die Verhüttung von Eisen mindestens seit ca. 1300 v. Chr.[12] Zwischen 1600 und 1200 v. Chr. blieb die Eisenproduktion weitgehend ein Monopol des Hethitischen Reiches und war ein Faktor für dessen Aufstieg. Ab 1200 v. Chr. wurde in der Levante Stahl durch Erhöhung des Kohlenstoffanteils produziert.[13]] Die Hethiter stellten aus dem Eisen, das anfänglich mit bis zum achtfachen Gewicht in Gold aufgewogen wurde,[14] vorwiegend Schmuck her.[15] In der späten Hethiterzeit gab es Eisen schon so häufig, dass es in Inventarlisten nicht mehr mit den Edelmetallen, sondern zusammen mit Kupfer geführt wurde. Von einem Monopol der Hethiter kann jedoch keine Rede sein: Einzelstücke aus terrestrischem Eisen aus der Mittleren und Späten Bronzezeit fanden sich auch in Griechenland und Zypern, in Jordanien, Libanon, Israel und Ägypten.[16]
Der Beginn der Eisenzeit wird für den Nahen Osten im Allgemeinen auf das Jahr 1200 v. Chr. festgesetzt – nicht weil Eisen ab diesem Zeitpunkt eine nennenswerte Rolle spielte, sondern weil innerhalb kürzester Zeit die Kulturen der Bronzezeit kollabierten. Die ersten Jahrhunderte der Eisenzeit sind in dieser Region ein „dunkles Zeitalter“, in dem viele Städte zerstört wurden, der Fernhandel zusammenbrach und die Metallproduktion nahezu einschlief. Erst ab etwa 700 v. Chr., als sich die Kulturen wieder vom Zusammenbruch erholten, wurde Eisen wieder häufiger. Seit 1200 v. Chr. ist in dieser Region auch nach der Stadt Damaskus genannte Damaszenerstahl oder Schmelzdamast bekannt, der einen sehr hohen Kohlenstoffgehalt von etwa 1,5 % und beim Polieren ein charakteristisches Muster aufweist. Dieser Werkstoff ist jedoch nicht nur im Nahen Osten, sondern bereits früher in anderen Regionen bekannt, so zum Beispiel in Südindien, wo er spätestens seit 300 v. Chr. hergestellt wird.[16]
Das Zustandschaubild Eisen - Kohlenstoff
Die Zustandsdiagramme von Zweistoffsystemen wurden bereits, in Kap. 1.2, genauer beschrieben.
Das System Eisen-Kohlenstoff ist ebenfalls ein Zweistoffsystem, dieses stellt sich jedoch etwas komplizierter dar als die unter 1.2 beschriebenen Phasendiagramme.
Es handelt sich bei den beiden Komponenten dieses Zweistoffsystems um Eisen (Fe) und Kohlenstoff (C). Der Teil des Eisen-Kohlenstoff-Diagramms, den wir betrachten, ist jedoch nur ein Ausschnitt aus dem gesamten Zustandsdiagramm. Denn der Teil, der für die Werkstofftechnik interessant ist, erstreckt sich von 0% Kohlenstoff bis 6,67% Kohlenstoff. Der Bereich des Eisen-Kohlenstoff-Diagramms, der über 6,67% Kohlenstoffgehalt (Masseanteil) hinaus geht, wird also nicht betrachtet.
Die folgende Grafik zeigt das Eisenkohlenstoff-Diagramm, danach folgt eine Beschreibung der wichtigsten Bereiche, Punkte und Linien, die darin abgebildet sind.
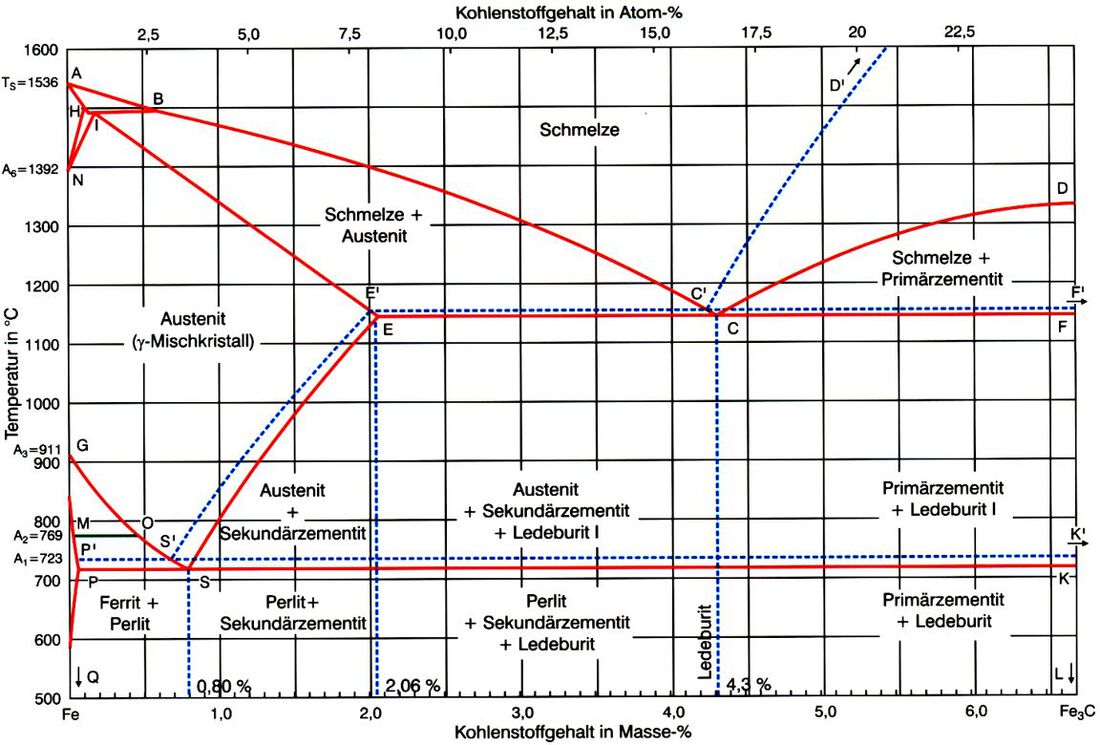
Zusätzlich zu den unter 1.2.1 genannten und beschriebenen Haltepunkten werden bei Eisen - Kohlenstofflegierungen und bei legiertem Stahle weitere Kennzeichnungen verwendet
| Kurzzeichen | Bezeichnung | Bezeichnung D | Bedeutung |
|---|---|---|---|
| Ac1 | arrēt chauffage 1 | Erwärmung Haltepunkt 1 | Temperatur bei der sich bei C-Stählen Austenit bildet |
| Ac3 | arrēt chauffage 3 | Erwärmung Haltepunkt 3 | Temperatur bei der die Umwandlung des Ferrits in Austenit abgeschlossen ist |
| Accm | arrēt chauffage cm | Erwärmung Haltepunkt cm | zusätzliche Kennzeichnung zu c, Temperatur bei der Zementit vollkommen in Lösung gegangen ist und nur noch Austenit vorhanden ist |
| Ac1b | arrēt chauffage 1b | Haltepunkt 1b, auf einer Aufheizkurve | Temperatur bei der sich bei legierten-Stählen Austenit bildet |
| Ac1e | arrēt chauffage 1e | Haltepunkt 1e, auf einer Aufheizkurve | Temperatur bei bei legierten-Stählen die Perlitauflösung beendet ist |
Zustandsschaubilder Fe-X
| Für die Zustandsschaubilder der verschiedenen Elemente mit Eisen wurde eine eigene WIKI Seite erstellt. |
| Zustandsschaubilder Fe-X |
Die Legierungselemente im Stahl
Was ist der Unterschied zwischen Stahl und Eisen?
Stahl ist ein Material, in dem das Gewichtsverhältnis von Eisen grösser ist als jedes andere Element (Legierungselement) und kann bis zu 2,06 % Kohlenstoff enthalten. Die Grenze von 2,06% Kohlenstoff wurde vereinbart als Grenze welche den Stahl vom Gusseisen unterscheidet. Einfach gesagt
- Stahl ist eine Legierung, Verbindung mit Eisen, Kohlenstoff und anderen Legierungselementen mit weniger als 2,06% C
- Eisen (Gusseisen) ist eine Legierung, Verbindung mit Eisen, Kohlenstoff und anderen Legierungselementen mit mehr als 2,06% C
Einfluss der Legierungselemente im Stahl
An keinem anderen Werkstoff lassen sich die Eigenschaften durch Legieren in einem so großen Umfang ändern wie bei Stahl. Der legierte Stahl enthält außer Eisen und Kohlenstoff im allgemeinen mehrere Legierungselemente. Wegen der komplexen Wechselwirkungen zwischen den Legierungselementen und ihrer nicht additiven Wirkung lassen sich die eingetretenen Eigenschaftsänderungen daher nur in sehr allgemeiner Form angeben.
Legierungselemente werden dem Stahl in genauen Mengen zugesetzt, um bestimmte Eigenschaften zu erzeugen bzw. zu verbessern oder unerwünschte zu beseitigen oder zu mildern. Als legiert gelten Stahlsorten, wenn der Legierungsgehalt für wenigstens ein Element die Grenzwerte der nachfolgenden Tabelle erreicht oder überschreitet. Die unerwünschten Beimengungen (Verunreinigungen) wie z. B. Phosphor, Schwefel, Stickstoff und die für das Desoxidieren erforderlichen Elemente gelten danach nicht als Legierungselemente.
Die Abgrenzung der unlegierten von den legierten Stählen, ergolgt mit den maßgebenden Gehalten der Legierungselemente nach DIN EN 10020.
Nach DIN EN 10027-1 werden lediglich unlegierte und legierte Stähle unterschieden. Die legierten Stähle teilt man in der Praxis z.Zt. noch häufig in die niedriglegierten und hochlegierten ein. Diese Festlegung dient aber lediglich dem Zweck einer einfacheren Namengebung und verfolgt nicht die Absicht, den Begriff legierter Stahl festzulegen.
- Unlegierte Stähle
- Stähle, denen außer zum metallurgischen Prozess erforderlich, keine weiteren Legierungselemente zugefügt wurden
- Niedriglegierte Stähle:
- Der Gehalt keines Legierungselementes überschreitet 5 %.
- Hochlegierte Stähle:
- Der Gehalt eines Elementes beträgt mindestens 5 %.
Die nachfolgende Tabelle gibt den max. % Anteil der zulässigen Element im unlegierten Stahl wieder.
| Unlegierter Stahl, nach DIN EN 10020 |
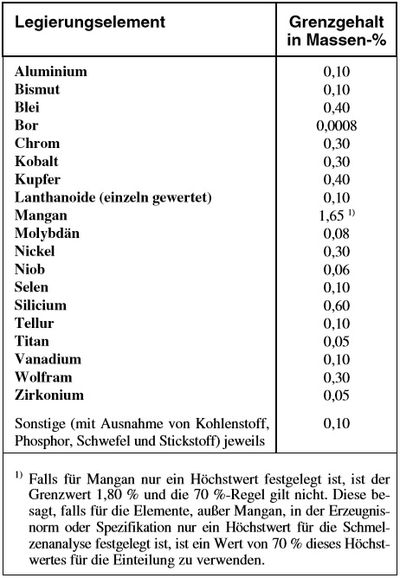
|
Legierungselemente im Stahl
Nachfolgend die wichtigsten Legierungselemente im Stahl, in alphabetischer Reihenfolge[17] und Ihr Einfluss auf die Eigenschaften des Stahles.
| Legierungs-element | Kurz-bezeichnung | Positive Eigenschaften | Negative Eigenschaften |
|---|---|---|---|
| Aluminium | Al | Aluminium wirkt in Eisen als starkes Desoxidationsmittel zur Stahlberuhigung (beim Gießprozess). Aluminium bildet außerdem mit Stickstoff Nitride (=> Nitrierstahl), es erhöht die Zunderbeständigkeit und erhöht die Koerzitivkraft. Außerdem wirkt Aluminium in hoch legierten Stählen ferritstabilisierend. | |
| Beryllium | Be | Durch die Wirkung von Beryllium als Legierungselement in Eisen wird das γ-Gebiet (Austenit) abgeschnürt. Beryllium wirkt als starkes Desoxidationsmittel bei der Stahlherstellung und es erhöht die Ausscheidungshärtung. | Als negative Wirkung senkt Beryllium als Legierungselement in Eisen die Zähigkeit. |
| Bor | B | Bor verzögert die Austenitumwandlung in der Ferritstufe bereits in sehr geringen Massenanteilen sehr wirkungsvoll. Im Bereich erhöhter Temperaturen verbessern mit Bor gebildete Ausscheidungen die Festigkeit austenitischer CrNi-Stähle. Bor wirkt als Legierungselement in Eisen als starker Neutronen-Absorber. Diese Arte der Legierung findet daher in Stählen für den Atomkraftwerksbau Verwendung. Bor erhöht die Streckgrenze und Festigkeit des Stahls und wird als Substitutionselement bei Vergütungsstählen eingesetzt. Z.B. für Schrauben 34MnB5, 36CrB4 usw. |
Ein negativer Effekt von Bor als Legierungspartner ist, dass es die Korrosionsbeständigkeit verringert und bei Gusseisen mit Kugelgraphit zur Versprödung führt. |
| Cer | Ce | Cerium wirkt in Eisen als Desoxidationsmittel und es erhöht die Zunderbeständigkeit. Es fördert bei Gusseisen mit Kugelgraphit (GGG) die Bildung von Kugelgraphit. Außerdem sind Eisen-Legierungen mit bis zu 30% Ce, Eisen pyrophor (wird in Feuerzeugen als Feuerstein verwendet). | |
| Chrom | Cr[1] | Chrom gehört zu den wichtigsten Legierungselementen der Stähle. Das Legierungselement Chrom wird neben Mangan und Molybdän am häufigsten zur Verbesserung der Gebrauchseigenschaften von Maschinenbaustählen eingesetzt. Chrom verändert die Eigenschaften des Stahles hauptsächlich durch die Bildung harter Chromcarbide und in untergeordnetem Maße auch durch die Mischkristallbildung. Weiterhin bewirkt Chrom in Gehalten über 12,2 % die Bildung submikroskopisch dünner, selbstheilender oxidischer Schutzschichten (Passivschichten) auf der Stahloberfläche und verbessert dabei die Korrosions- und Zunderbeständigkeit dieser Stähle erheblich.
Durch Herabsetzen der kritischen Abkühlgeschwindigkeit wird die Einhärtbarkeit wesentlich gesteigert. Eine Erhöhung der Härte wird weiterhin durch die karbidbildende Wirkung des Chroms hervorgerufen. Höhere Chromgehalte verbessern die Warmfestigkeit und Anlaßbetändigkeit. Die Zunderbeständigkeit wird insbesondere in Kombination mit Silizium oder Aluminium erhöht. Chromstähle sind gut härt- und vergütbar. Chrom verringert die Lösungsfähigkeit des Austenits für Kohlenstoff. Bereits geringere Chromgehalte führen dabei zu einer Verschiebung der Punkte S und E im EKD nach links, so dass, abhängig vom Chromgehalt, ein Stahl bereits bei Kohlenstoffgehalten unter 0,8 % übereutektoid ist und infolge der Chromcarbide eine höhere Verschleißbeständigkeit hat. Auch das Auftreten von Ledeburiteutektikum wird zu niedrigeren Kohlenstoffgehalten hin verschoben. So enthält ein Stahl mit etwa 10% Cr bereits bei einem Kohlenstoffgehalt von rund 1 % Ledeburit. Dies führt zu den ledeburitischen Kaltarbeitsstählen. Bei höheren Gehalten schnürt Chrom das Austenitgebiet ab. Von technischer Bedeutung sind dabei auch die ferritischen und halbferritischen Chromstähle. In hochchromhaltigen Stählen führt Chrom jedoch auch zu einer Reihe unerwünschter Erscheinungen wie Begünstigung von interkristalliner Korrosion und 475°C-Versprödung sowie zur Ausscheidung spröder, intermetallischer a-Phase. |
Vorteilhafte Eigenschaften:
Nachteilige Eigenschaften:
Verwendungsbeispiele:
|
| Kohlenstoff | C | Die Wirkung von Kohlenstoff ist für die Werkstofftechnik von sehr hoher Bedeutung. Zum einen senkt Kohlenstoff als Legierungselement in Eisen den Schmelzpunkt, während er durch Fe3C-Bildung die Härte und Zugfestigkeit erhöht. Eine Eisenlegierung wird außerdem als Stahl bezeichnet, wenn der Kohlenstoffgehalt zwischen 0,002 % und 2,06 % liegt. Stahl lässt sich jedoch erst ab einem Kohlenstoffgehalt von 0,3% härten.
|
Kohlenstoff erhöht in größeren Mengen die Sprödigkeit und senkt damit Schmiedbarkeit, Schweißeignung, Bruchdehnung und Kerbschlagarbeit. |
| Kobalt | Co | Erhöht die Warmfestigkeit | Erhöht die Anlasssprödigkeit |
| Kupfer | Cu | Kupfer erhöht als Legierungselement in Eisen die Witterungsbeständigkeit und Festigkeit. | Die Bruchdehnung wird deutlich verringert. |
| Mangan | Mn | Mangan verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts.
Wird Mangan im Stahl zulegiert, verbessert es
|
|
| Molybdän | Mo | Molybdän verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts. Der Haltepunkt A1 wird leicht nach oben verschoben. Molybdän erhöht die
Die dafür notwendigen Molybdängehalte liegen zwischen 0,2 und 0,4%.
|
Molybdän senkt die Schmiedbarkeit und Dehnbarkeit (bei hohem Mo-Anteil) |
| Nickel | Ni | Nickel erhöht in Stahl die die Zugfestigkeit und die Streckgrenze. Nickel gehört zu den Legierungselementen, die eine Erstarrung nach dem stabilen Eisen-Kohlenstoffsystem begünstigen. Durch die Verringerung der kritischen Abkühlgeschwindigkeit erhöht Nickel die Einhärtung und Durchvergütung. Weiter erhöht Nickel vor allem die Zähigkeit, besonders im Tieftemperaturgebiet, wirkt kornfeinend und senkt die Überhitzungsempfindlichkeit. Ab einem Anteil von 8% macht Nickel einen Stahl korrosionsbeständig, der 18/10 Chrom-Nickel-Stahl zählt zu den Hauptvertretern der korrosionsbeständigen austenitischen Stähle. Der Wärmeausdehnungskoeffizient von Stählen erreicht bei 36% Nickel ein Minimum (Invarstahl). Der elektrische Widerstand wird durch Nickel erhöht (Heizleiterdrähte, Konstantan). |
Ein nachteiliger Einfluss von Nickel auf Stahl ist, dass es den Haltepunkt A1 um 10 K je 1% Ni nach unten verschiebt. Außerdem wirkt Nickel in hoch legierten Stählen ferritstabilisierend. |
| Phosphor | P | unerwünschtes Begleitelement
|
P hebt den Haltepunkt A1 leicht an und führt zu Versprödung.
|
| Schwefel | S | Unerwünschtes Begleitelement
|
|
| Silizium | Si | Silizium erhöht in Eisen-Legierungen die Zunderbeständigkeit, es ist ein Mischkristallhärter und behindert die Bildung von Carbiden. Bei der Stahlherstellung hat es die positive Wirkung die Schmelze dünnflüssiger zu machen und dient als Desoxidationsmittel. Ein weiterer positiver Einfluss von Silizium auf Stahl ist, dass es die Zugfestigkeit, Streckgrenze und Zunderbeständigkeit erhöht.
Darüber hinaus verschiebt Silizium den Haltepunkt A1 nach oben (um 20 - 30 K je 1% Si, jedoch nur bis 3%). Es verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts. Außerdem wirkt Silizium in hoch legierten Stählen ferritstabilisierend. |
|
| Stickstoff | N | Stickstoff verbessert Spannungsrisskorrosionsbeständigkeit, Kaltverfestigung, Festigkeit | Stickstoff erhöht Blausprödigkeit, Alterungsempfindlichkeit |
| Titan | Ti | Titan verhindert als Legierungselement in Eisen-Legierungen die interkristalline Korrosion durch Bildung von TiC. | |
| Vanadium | V | Vanadium erhöht in Eisen-Legierungen die Zugfestigkeit, es verschiebt den Haltepunkt A1 leicht nach oben. Vanadium erhöht den Verschleißwiderstand, die Warmfestigkeit und die Anlassbeständigkeit |
|
| Wolfram | W | Wolfram wirkt als Carbidbildner und erhöht somit die Zugfestigkeit deutlich. Verschiebt den Punkt S (Eutektoid) im Eisen-Kohlenstoff-Diagramm weiter nach oben in den Bereich höherer Temperatur und den Punkt E nach oben links in den Bereich höherer Temperatur und geringeren Kohlenstoffgehalts. |
Einfluss der Legierungselemente auf die Eigenschaften des Stahls
Die nachfolgende Graphik gibt den Grundsätzlichen Einfluss des Kohlenstoffes C und des Legierungselementes Chrom Cr im Stahl wieder.
- Kohlenstoff ist das Legierungselement das ausschließlich für die Härte im Stahl verantwortlich ist, also die Aufhärtbarkeit.
- Chrom ist eines der Legierungselemente welches die Einhärtbarkeit erhöht, also die Tiefe des in Martensit umgewandelten Gefüges.
| Einfluss der Legierungselemente auf die Aufhärtung und Einhärtung bei Stahl[18] |
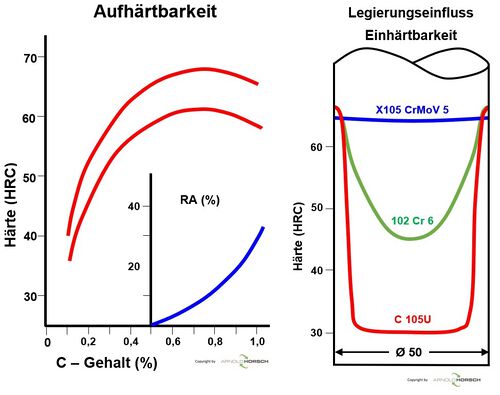
|
Einfluss der Legierungselemente auf die Einhärtbarkeit des Stahls
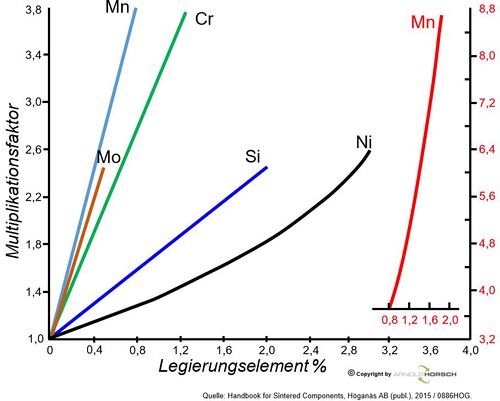
Nicht alle Legierungselemente beeinflussen die Einhärtbarkeit des Stahles gleich, die wichtigsten Elemente zur Steigerung der Einhärtbarkeit sind Mn, Mo und Cr. Zur Darstellung des Einflusses und zum abschätzen der Einhärtbarkeit kann die nachfolgende Graphik zur Vereinfachung genutzt werden.
| Einfluss der Legierungselement auf die Einhärtbarkeit, mit Multiplakationsfaktor des Legierungseinflusses[19] | Werkstoff 50CrV4, Einfluss auf das ZTU Verhalten von 2 Schmelzen. Gut erkennbar die Verschiebung der Abkühlzeit zu höheren Zeiten durch einen steigenden Cr-Gehalt von 0,2%, bei gleichzeitig niedrigerer Härte durch den fallenden C-Gehalt um 0,1%. Sehen wir uns den Multiplikationsfaktor von Cr an beträgt der bei bei etwa 0,2% unterschied 1,5, die Abkühlzeit bis zur Martensitbildung beträgt bei Schmelze 1 ca. 30sec. und bei Schmelze 2 ca. 50sec., der Einfluss der anderen Legierungselement mitgerechnet entspricht dies etwa einem Multiplikationsfaktor von ca. 1,6 = 30sec. x 1,6 = 48 sec. |
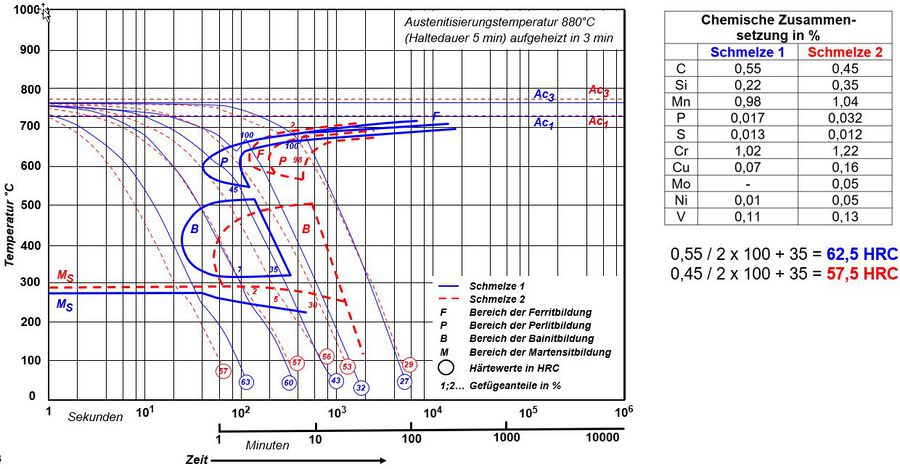
|
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 Volker Läpple, Berthold Drube , Georg Wittke, Catrin Kammer ,Werkstofftechnik Maschinenbau – 5. Auflage, VERLAG EUROPA-LEHRMITTEL, Haan-Gruiten
- ↑ Friedrich Cornelius: Geistesgeschichte der Frühzeit. Band 1, Verlag Brill Archive, 1960, S. 132.
- ↑ Arnold Horsch, Vortrag, Die Werkstoffprüfverfahren, Seminar Härteprüfung in Theorie und Praxis, Arnold Horsch
- ↑ 4,0 4,1 4,2 4,3 https://www.wikiwand.com/de/Stahl, Wikipedia, eingefügt 14.08.2019
- ↑ https://de.wiktionary.org/wiki/wrought_iron, eingefügt 17.10.2020
- ↑ Wikipedia - https://de.wikipedia.org/wiki/Eisen#Eisenerzeugung_aus_Erz
- ↑ https://www.wikiwand.com/de/Etymologie
- ↑ Kluge, Etymologisches Wörterbuch der deutschen Sprache, 21. Aufl., S. 160–161
- ↑ Julius Pokorny, Herkunft und Etymologie des Wortes Eisen. In: Zeitschrift für vergleichende Sprachforschung 46, 1914, S. 128–150
- ↑ Pfeifer: Etymologisches Wörterbuch des Deutschen, 212. Aufl. 1993.
- ↑ Otto Johannsen, Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 40.
- ↑ Otto Johannsen: Geschichte des Eisens. 3. Auflage, Verlag Stahleisen, Düsseldorf, 1953, S. 44.
- ↑ Charles Burney: Historical Dictionary of the Hittites. Historical Dictionaries of Ancient Civilizations and Historical Eras. Scarecrow Press, 2004. ISBN 978-0-8108-6564-8, S. 135–136.
- ↑ Charles Burney: Historical Dictionary of the Hittites. Historical Dictionaries of Ancient Civilizations and Historical Eras. Scarecrow Press, 2004. ISBN 978-0-8108-6564-8, S. 135–136.
- ↑ Richard A. Gabriel: The Great Armies of Antiquity. Greenwood Publishing Group, 2002. ISBN 978-0-275-97809-9, S. 75.
- ↑ 16,0 16,1 Florian Neukirchen: Von der Kupfersteinzeit zu den Seltenen Erden - Eine kurze Geschichte der Metalle. Springer-Verlag, 2016, ISBN 978-3-662-49347-2, S. 65
- ↑ http://www.maschinenbau-wissen.de/skript3/werkstofftechnik/stahl-eisen/38-einfluss-legierungselemente-stahl
- ↑ Siegener Werkzeug und Härtetechnik GmbH, Seminar "Was man in der Stahlindustrie über Wärmebehandlung wissen sollte
- ↑ Handbook for Sintered Components, Höganäs AB (publ.), 2015 / 0886HOG.